Lo nuevo

La Catástrofe Ultravioleta y el infinito (parte III)

La Catástrofe Ultravioleta y el infinito (parte II)

La Catástrofe Ultravioleta y el infinito (parte I)

Calculo de la distancia a una supernova con la ley de Hubble







Hoy continuamos fijándonos en objetos de la vida cotidiana y preguntándonos sobre su origen y funcionamiento dentro de la serie Inventos ingeniosos. Por si eres nuevo y no conoces esta serie, en ella tratamos de mostrar cómo hasta las cosas más triviales tienen una historia interesante detrás, y cómo el ingenio y el tesón pueden llegar a conseguir cosas que, de primeras, parecen extraordinarias. Tras hablar del pegamento, hoy lo haremos de otro invento que tiene que ver con la Química. Hablaremos del jabón.

Como tantas invenciones de la serie, se trata de algo realmente ingenioso (o no estaríamos hablando de él) y, como tantas otras veces, su descubrimiento fue accidental. Porque las claves del funcionamiento del jabón tienen que ver con la Química en general, y la Química Orgánica en particular, pero los seres humanos lo venimos utilizando desde hace milenios, comprendiendo su utilidad pero no el porqué de esa utilidad.
Para entender cómo y por qué el jabón funciona, hace falta en primer lugar recordar los conceptos de solubilidad y polaridad, algo que haremos aquí con un ejemplo lo más sencillo posible, y relacionado con lo que nos ocupa.
Imaginemos, ínclito lector de El Tamiz, que te has dado un buen chapuzón en el mar y, tras secarte al Sol, tu piel está cubierta de sal marina –en su mayor parte, cloruro de sodio, NaCl–. Librarte de esa costra de sal es muy fácil: no tienes más que darte un baño en una piscina de agua dulce, o darte una ducha rápida, y listo. Pero ¿qué está pasando realmente sobre tu piel?
Las moléculas de sal (de cloruro sódico o de cualquiera de las otras sales presentes en el océano) son moléculas polares. Si no has leído Conoce tus elementos y no sabes lo que son las capas electrónicas, te recomiendo que le des un repaso antes de seguir; el enlace formado entre el átomo de sodio y el de cloro se produce porque el sodio, con once protones y once electrones, si se libra de ese electrón tiene diez electrones, dos en la primera capa y ocho en la segunda, con lo que es estable. Y el cloro, por su parte, tiene diecisiete protones y otros tantos electrones, con lo que es estable si consigue un electrón más. Por lo tanto, al unirse ambos, el sodio cede su “electrón de sobra” al cloro, y ambos tan contentos. Pero entonces, el sodio tiene once protones y sólo diez electrones, con lo que queda cargado positivamente, y al cloro le sucede lo contrario. La consecuencia es que, dicho mal y pronto, ambos iones se quedan “pegados”.
Pero, aunque considerados juntos la carga positiva y la negativa estén en equilibrio (28 protones y 28 electrones), una parte del NaCl tiene carga positiva (el sodio) y la contraria tiene carga negativa. Es decir, hay un polo positivo y otro negativo, eléctricamente hablando. En términos del bloque de Electricidad que hemos empezado, la carga roja y la verde del NaCl están desdobladas. De hecho, esto es lo que hace que la sal forme cristales tan fácilmente, porque los iones van formando una especie de armazón –en este caso, de forma cúbica– que puede llegar a ser bastante grande, “enganchados” unos a otros por las cargas opuestas. Pero eso no es lo que nos interesa aquí; lo importante es que el NaCl, y el resto de sales del océano, son polares.
El caso del agua (H2O) es diferente, pero no tanto como pudiera parecer. El enlace entre los hidrógenos y el oxígeno es en este caso un enlace covalente, en el que cada par de átomos comparte electrones; cada hidrógeno comparte uno con el oxígeno, con lo que el oxígeno (que tiene ocho protones y los mismos electrones) gana dos electrones y, con diez, tiene una configuración estable. Y lo mismo hace el oxígeno, que comparte un electrón con cada hidrógeno, de modo que cada H tiene dos electrones (en vez de uno, como antes de unirse al oxígeno), la configuración electrónica del helio, que también es estable. Una vez más, todos contentos, sólo que esta vez, en lugar de que un átomo “regale” electrones al otro, los átomos comparten los electrones como iguales.
¿Como iguales? No tanto. Como sabes si has leído Conoce tus elementos (o si tienes ciertas nociones de Química), el oxígeno es uno de los elementos más electronegativos –más “hambrientos de electrones”–; tan sólo el flúor le gana en ese aspecto. El hidrógeno también tiene “hambre de electrón” para ser estable, pero ni de lejos tanto como el oxígeno. Como consecuencia, aunque nominalmente compartan esos electrones, en la realidad los electrones pasan bastante más tiempo cerca del oxígeno que de los hidrógenos, y al final sucede algo parecido al caso del NaCl (aunque no tan exageradamente): que el extremo de la molécula de agua donde están los hidrógenos tiene carga ligeramente positiva, y el del oxígeno, ligeramente negativa. Una vez más, cargas “desdobladas”.
¿Qué pasa entonces cuando te das esa ducha? Que el sodio se ve atraído por el extremo del oxígeno del H2O, y lo contrario le sucede al cloro: se ve atraído por los hidrógenos cargados positivamente. Como consecuencia, según el agua fluye sobre tu piel, va “atrapando” la sal que había en ella: la sal se disuelve en el agua. Lo mismo sucede con cualquier otra molécula polar que pueda ensuciar tu piel, tu pelo o tu ropa.
Pero ¿qué hay de las moléculas que no son polares? El ejemplo más fácil es el aceite: al tratarse de moléculas no polares (apolares), se disuelven muy mal en agua, porque el truco de “pegar la parte negativa con la positiva y viceversa” no funciona en absoluto. De ahí que, como sabes, el agua y el aceite sean inmiscibles, y si te manchas la piel con aceite y te das una ducha, sigues estando resbaladizo y grasiento. Y la solución no es mantenerse alejado del aceite, porque lo mismo le sucede a las demás grasas, como el sebo, la mantequilla, la grasa de nuestra propia piel y pelo… ¿Cómo librarse de ellas? Es un verdadero problema, porque muchas de las cosas que nos ensucian son grasas de un tipo u otro.
Para lograrlo hay dos soluciones: una es conseguir un disolvente que logre disolver, por ejemplo, el aceite. Para eso es necesario un disolvente apolar, como el propio aceite: por ejemplo, el cloroformo. Las desventajas de este sistema son que muchos de ellos son tóxicos en sí mismos o desprenden vapores que lo son, y que para producirlos hace falta una industria química relativamente avanzada (algo que nuestros antepasados no tenían). Pero hay otra solución mucho más ingeniosa.
La sal, por ejemplo, no se disuelve en aceite porque las moléculas de sal son polares y el aceite no lo es. Pero sí se disuelven en agua por lo contrario. Lo ideal sería, entonces, tener una molécula que fuera polar (y se disolviera en agua) y también apolar (para que se disolviera en aceite); pero esto, claro, es contradictorio… salvo que tengamos una molécula con una parte similar a la sal (polar) y otra similar al aceite (apolar), con la suficiente distancia entre ellas como para que, al exterior, le parezcan moléculas distintas, aunque estén unidas por una cadena de átomos más o menos larga que las mantenga unidas.
Este dibujo (que no representa ninguna molécula concreta ni pretende seguir el menor convenio de química orgánica ni tener ningún rigor) tal vez te aclare lo que quiero decir:
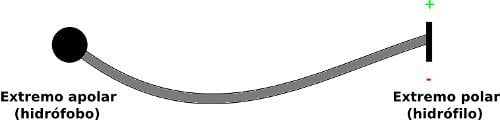
En algunos casos, la parte polar tendrá tanto un polo positivo como otro negativo, y en otras ocasiones sólo tendrá uno de ellos, pero el resultado es el mismo: que esa parte se disuelve muy bien en agua. Una molécula así podría disolverse en aceite y en agua al mismo tiempo. El extremo de la derecha puede disolverse en agua (es hidrófilo), y el de la izquierda no, es hidrófobo, pero al ser apolar puede disolverse en aceite, o en mantequilla. Y lo normal sería que cada extremo se fuera por su lado, disuelto en el disolvente que mejor le viene… pero, como ambos extremos están unidos porque son, al fin y al cabo, parte de la misma molécula, estamos uniendo el agua con la mantequilla sin posibilidad de separación:
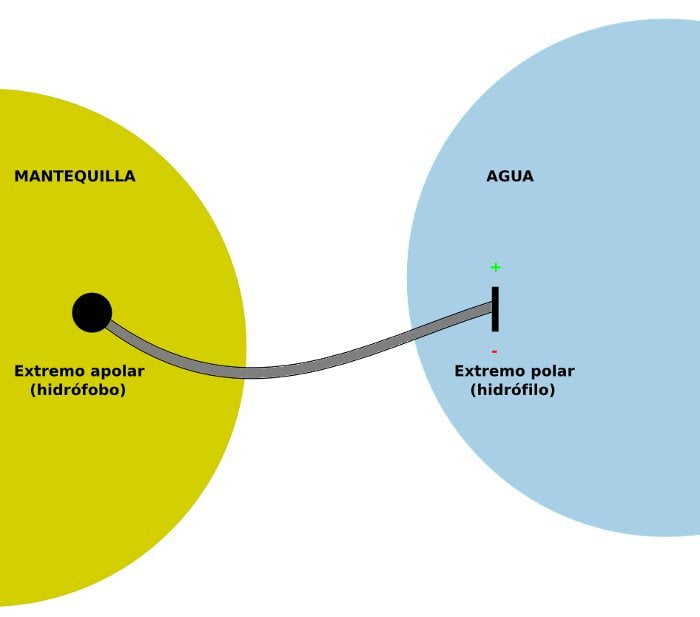
Si mis manos estuvieran, por ejemplo, cubiertas de mantequilla, podría mojarlas (pero el agua no se uniría a la mantequilla), y entonces añadir este tipo de moléculas, con lo que tendría una especie de ménage à trois entre la mantequilla, esta extraña molécula y el agua. Como normalmente habrá bastante más agua que mantequilla, lo que sucedería es que estas moléculas formarían auténticos “corrales”, encerrando la mantequilla en pequeñas burbujas unidas por muchas de ellas al agua circundante. Y, cuando luego me aclarase la mano con abundante agua, al llevarse el resto del agua sobre mi piel, el agua se llevaría consigo la extraña molécula unida a ella, y la extraña molécula se llevaría la mantequilla, con lo que me habría librado, por fin, de la grasa que cubría mi piel.
Estas “moléculas extrañas” que por un lado son polares y se disuelven en disolventes polares (como el agua) y por el otro son apolares y se disuelven en disolventes apolares (como el aceite) se llaman moléculas anfipáticas o anfifílicas. Hay varios tipos pero, como ya te habrás imaginado a estas alturas, especialmente tras el ejemplo de las manos y la mantequilla, el jabón es una de ellas. Ah, pero ¿cómo demonios consigue uno una molécula tan peculiar?
Evidentemente, hay muchas maneras de hacerlo, pero hay una especial por lo relativamente sencillo que resulta con una tecnología no demasiado avanzada. Ya sé que, al principio, puede parecer imposible obtener una molécula así según el proceso que voy a describir salvo que uno tenga conocimientos de Química bastante extensos pero, como veremos luego, la casualidad a veces sorprende.
Como seguro que sabes si tienes nociones de Química, cuando un ácido y una base reaccionan, se produce una sal y otras moléculas (como agua). Existe un tipo especial de reacciones ácido-base de este tipo, en química orgánica, en la que el ácido es un ácido graso y la base es un hidróxido (por ejemplo, NaOH o KOH); se trata de reacciones de saponificación, y el resultado es una sal, pero no cualquier tipo de sal: una sal cuya molécula es bastante larga, y uno de cuyos extremos es polar e hidrofílico, mientras que el otro es apolar e hidrofóbico. ¿Te suena? Esta sal es un jabón.
¿Dónde conseguir los dos ingredientes esenciales para producir estas sales tan peculiares, si no se dispone de una industria química avanzada? Del hidróxido de potasio, KOH, también llamado potasa cáustica, ya hemos hablado anteriormente en El Tamiz: no es difícil obtenerlo a partir de la potasa producida mediante cenizas vegetales. El hidróxido de sodio, que es una base más fuerte, es más difícil de obtener, de modo que no sería empleado hasta bastante más tarde. Respecto a los ácidos grasos, ahí no hay problema, pues se pueden obtener a partir de muchas grasas animales o vegetales, especialmente al hacerlas reaccionar con… ¡sorpresa!, un hidróxido de sodio o potasio, por ejemplo.
Con lo que, por un lado, los ingredientes básicos para producir un jabón han estado con nosotros casi desde siempre: hemos dispuesto de cenizas vegetales y grasas desde los albores del tiempo. Pero, por otro lado, hace falta que –por casualidad o intencionadamente– alguien realice el proceso adecuado. Dicho mal y pronto, hace falta “cocinar” la grasa con el hidróxido, de modo que se produzca la reacción de saponificación. Si lo que reaccionase fuera directamente el ácido graso, se produciría simplemente jabón (la sal), pero cuando lo que reacciona es la grasa, se obtiene un producto adicional, la glicerina, de un modo parecido al siguiente:
Grasa saponificable + Hidróxido -> Jabón + Glicerina
Por ejemplo, si el hidróxido es KOH, se puede obtener la sal palmitato de potasio (C16H31KO2)junto con la glicerina, y esa sal es un jabón (de la glicerina hablaremos dentro de un momento). La molécula de palmitato potástico es, como debe ser, una larga cadena, con un extremo polar (un oxígeno con carga negativa y el potasio con carga positiva) y otra apolar. Pero, aunque los ingredientes no sean muy raros y el proceso no sea complejo, ¿a quién se le ocurre cocinar grasa con potasa cáustica en una olla?
No lo sabemos. Se trata, desgraciadamente, de algo tan antiguo que sólo podemos guiarnos por escritos y recetas, y únicamente podemos especular acerca de la mente (o mentes, en diversos lugares) con el suficiente ingenio para probar algo así, si no se trató de pura casualidad. Dado que la Química no se había desarrollado aún, parece casi seguro que la casualidad tuvo que desempeñar un papel más o menos grande: incluso si alguien se dedicó a mezclar diversas sustancias para ver los resultados, no era posible predecir lo que iba a suceder en este caso. En mi opinión, no fundada en nada sólido, lo más probable es que la casualidad produjese alguna sustancia jabonosa, y luego el proceso fuera mejorado y realizado de manera sistemática.
Existen menciones de recetas, procesos y sustancias relacionados con el jabón desde hace milenios. Una receta encontrada en una tablilla babilónica de alrededor de 2200 a.C. habla de mezclar agua, aceite de cassia y una sal alcalina, lo que produciría sin duda una sustancia jabonosa y nos hace pensar que los babilonios de la época ya empleaban el jabón, aunque no sabemos para qué (puede haber sido para lavar ropas, para el pelo, o para lavar su piel). Los egipcios también lo conocían: el papiro de Ebers, de 1550 a.C., también menciona sustancias básicas y grasa combinadas para producir una sal jabonosa. El Antiguo Testamento tiene un par de menciones acerca de lavarse con sosa o jabón, aunque no está claro exactamente a qué se refiere.
Los griegos clásicos, por el contrario, no tienen mención alguna del jabón ni de recetas para producirlo. Los romanos tampoco lo conocieron durante siglos, y parece que lo conocieron por primera vez a través de los galos. El nombre latino de la sustancia era sapo –el origen de saponificación, el nombre inglés soap, y a través del romance sapone nuestro xabón, jabón–, que a su vez parece tener su origen en una palabra muy parecida de algún idioma germánico o céltico.
De vez en cuando se lee por ahí una supuesta leyenda clásica acerca del origen del jabón. De acuerdo con la leyenda, en las laderas del monte Sapo se realizaban sacrificios de animales. Cuando llovía, la ceniza de los fuegos de los altares se mezclaba con la grasa de los sacrificios, de modo que el jabón resultante llegaba a un arroyo cercano y las mujeres que allí lavaban la ropa descubrieron que podían lavar mucho mejor utilizando esa resbaladiza sustancia.
Existen varias razones por las que esta supuesta “leyenda romana” no tiene sentido (no me refiero a que la leyenda no describa hechos reales, sino a que no se trata de una leyenda clásica sino de algo inventado posteriormente). En primer lugar, no hay mención en los textos latinos de ningún monte Sapo, ni real ni legendario. En segundo lugar, la primera mención de la palabra sapo no se produce en textos romanos hasta el siglo I d.C., algo impensable si el jabón fuera algo conocido desde tiempos legendarios. Finalmente, conocemos bastante bien el origen no latino de sapogracias a los propios romanos. Plinio el Viejo lo describe por vez primera en el libro XXVIII de su Naturalis Historia, alrededor de 77 d.C.:
Prodest et sapo, Galliarum hoc inventum rutilandis capillis. Fit ex sebo et cinere, optimus fagino et caprino, duobus modis, spissus ac liquidus, uterque apud Germanos maiore in usu viris quam feminis.
Es decir, más o menos (corregidme sin misericordia los que sabéis latín):
También está el jabón, una invención de los Galos para hacer brillar su pelo. Se hace con sebo y cenizas, idealmente con cenizas de haya y grasa de cabra, y hay dos tipos, sólido y líquido; entre los Germanos, ambos tipos son usados más comúnmente por los hombres que por las mujeres.
Como ves, al principio el jabón les parecía a los romanos una exótica sustancia cuyo uso principal nada tenía que ver con la higiene. Hizo falta más de un siglo para que su uso se extendiese, y sólo hasta cierto punto. Tanto Galeno como el posterior Priscianus recomiendan su uso para lavar el cuerpo, y éste último hace incluso mención de una profesión, saponarius, dedicada específicamente a cocinar grasa con una base para obtener jabón. Eso sí, me imagino que los procesos más primitivos de fabricación, dependiendo del tipo de grasa y el filtrado posterior, debían de crear jabones de olor probablemente poco agradable y bastante agresivos, aunque la base del proceso se mantuviera durante siglos.
Tras la caída del Imperio de Occidente también decayó el uso del jabón, y hay que esperar hasta alrededor del año 1000 para que vuelvan a aparecer menciones de la sustancia y su proceso de fabricación en Europa. Con el tiempo, aunque la base del proceso se mantuviera, se fueron refinando los resultados, tanto por la elección de la grasa inicial como por los filtrados posteriores a la saponificación.
En 1776, el sueco Karl Wilhelm Scheele identificó por primera vez el otro producto de la saponificación de las grasas además del jabón, la glicerina, “el principio dulce de las grasas”, ya que forma parte de muchas de ellas y, efectivamente, tiene un sabor dulce. Sin embargo, fue el francés Michel Eugene Chevreul quien, a principios del XIX, describió con detalle la reacción completa, mediante la cual, como hemos dicho antes, el hidróxido “rompe” la molécula de grasa, obtiene el ácido graso y la glicerina, y luego reacciona con el ácido para formar el jabón. Y esta glicerina resultaba dar, de acuerdo con la cantidad que hubiera en el producto final, propiedades interesantes a los jabones.
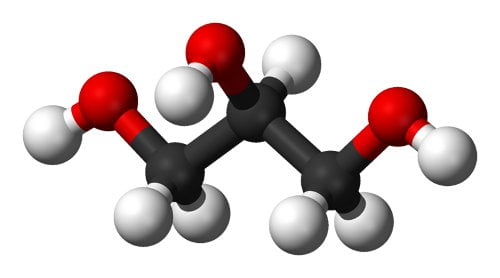
Además de proporcionar una textura suave al jabón, la glicerina o glicerol (C3H5(OH)3), este “principio dulce”, tiene una propiedad fundamental que la hace muy útil: es una molécula muy higroscópica, es decir, se solubiliza muy fácilmente en agua y tiene una gran “sed” de este líquido. De ahí que se utilice en muchísimos procesos de nuestra industria química, pero en el caso que nos ocupa, esta propiedad hace que un jabón que contenga, además de la sal jabonosa propiamente dicha, una cantidad razonable de glicerina, sea menos agresivo para la piel. Para empezar, la propia textura de la glicerina es sedosa y suave. Pero además, la glicerina está tan “sedienta de agua” que, al estar en contacto con el aire, se une a las moléculas de vapor de agua presentes, con lo que se vuelve húmeda muy rápidamente. Un jabón sin glicerina es mucho más “seco”.
Con el tiempo, a la base fundamental del jabón (la molécula de jabón propiamente dicha, para eliminar grasas y otros compuestos orgánicos apolares, y la glicerina para hidratar) se le fueron añadiendo otras sustancias, para conseguir beneficios adicionales. Un ejemplo evidente es la presencia, en casi todos los jabones, de algún tipo de perfume. También se pueden añadir metales pulverizados, como titanio o aluminio, que producen reacciones de oxidación-reducción sobre la piel de las bacterias, “robándoles” electrones, de modo que el jabón se convierte en un agente antibacteriano eficaz.
Por cierto: aunque la adición de sustancias antibacterianas hagan del jabón un antiséptico eficaz, llevamos usándolo de ese modo desde mucho antes de que se le añadiera nada “extra”, lo que significa que sus propiedades antisépticas no pueden depender únicamente de los añadidos posteriores. Sin embargo, no he hallado ninguna mención de por qué el jabón, puro y duro, mata bacterias. ¿Es simplemente una acción mecánica, al unirse al agua y las sustancias orgánicas, que “arrastra” la mayor parte de las bacterias tras amarrarse a los lípidos de la membrana? ¿O la acción antiséptica del jabón antiguo es un mito? Me temo que algún químico o biólogo tiene que subir a la palestra, porque a mí esta pregunta me viene grande.
Además de su utilidad para eliminar moléculas orgánicas apolares que no se disolverían por sí mismas en agua, el jabón tiene otra propiedad fundamental que resulta imposible de ignorar si lo usas: al añadir jabón al agua, el líquido resultante forma burbujas con gran facilidad. Cuando se añade aire (agitando el agua jabonosa, por ejemplo) se produce espuma, que no es más que un número muy grande de pequeñas burbujas de aire con paredes de agua jabonosa.
Este comportamiento del agua jabonosa se debe a que las moléculas de jabón –como otras además de ellas– son tensoactivas o surfactantes, es decir, modifican la tensión superficial del líquido al que se añaden. Para hablar de esto en detalle harían falta artículos específicos acerca de la tensión superficial y otras cosas, pero si has comprendido más o menos los tristes dibujos de arriba con la molécula anfipática “enganchada” al agua, como si de un arpón se tratara, puedes entender el fundamento básico de esta propiedad.

Al “clavar” tantas moléculas de jabón sobre el agua, la superficie del líquido pierde cohesión, ya que muchas moléculas de H2O ya no están unidas entre sí por la interposición de las moléculas de jabón, es decir, disminuye la tensión superficial. Seguro que has notado esto si, sobre agua con algo de aceite, dejas caer una gota de cualquier detergente. El agua jabonosa puede llegar a tener una tensión superficial tres veces menor que el agua sin jabón.
Y, aunque parezca contradecir la intuición, esta disminución de la tensión superficial permite la formación de burbujas más fácilmente. El agua sin jabón también forma burbujas cuando se agita (como se ve, por ejemplo, bajo una pequeña cascada en un arroyo), pero las burbujas desaparecen muy rápido porque las moléculas de agua “tiran” unas de otras hasta volver al redil del líquido. Sin embargo, si la superficie del agua tiene “clavadas” las moléculas de jabón y la tensión superficial es menor, este proceso se hace mucho más lento: no es que el jabón aumente la fuerza de la pared de la burbuja (¿cómo iba a hacerlo, si disminuye la tensión superficial?), como a veces se oye por ahí. Cuando oyes algunas explicaciones, parece como si la burbuja tuviera que ser fuerte para “contener el aire” de dentro… pero la presión del aire de dentro no es más grande que la de fuera, y esto no es un globo.
El jabón estabiliza la pared de la burbuja, evitando hasta cierto punto que las propias moléculas de agua se junten de nuevo para formar una o muchas gotas. También ralentiza la evaporación, ya que la superficie de agua expuesta al aire es más pequeña, pero esta contribución a la estabilidad de las burbujas es mucho menos importante que la otra.
De hecho, hoy en día las propiedades tensoactivas son tan valoradas que se emplean moléculas con ese propósito específico. Aunque, como siempre en la serie, lo que más nos interesa es el funcionamiento básico del invento y su origen histórico, y no tanto los desarrollos más modernos, no puedo dejar de mencionar algunas cosas sobre los jabones modernos, porque si miras el envase de cualquier champú, pasta de dientes o jabón líquido (no tanto las pastillas tradicionales de jabón) verás que hay un par de ingredientes que se repiten muy a menudo.
En primer lugar, seguro que casi siempre verás uno de estos dos ingredientes: Sodium laureth sulfate (CH3(CH2)10CH2(OCH2CH2)nOSO3Na), donde “n” puede tomar varios valores, porque se trata de una cadena de longitud variable) o Sodium lauryl sulfate, (C12H25SO4Na). En ambos casos se trata de sales con moléculas muy largas, y uno de cuyos extremos es polar, mientras que el otro es apolar. Sí, si… son nombres sofisticados, pero sigue siendo jabón (aunque en este caso no sé cómo los producen, se agradece información adicional). Observa los diagramas simplificados de ambas moléculas, y cómo en ambos casos, en un extremo hay un oxígeno cargado negativamente cerca de un sodio cargado positivamente, una larga cadena y otro extremo sin carga:
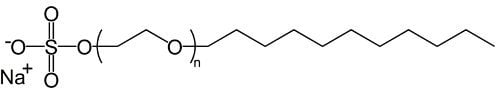
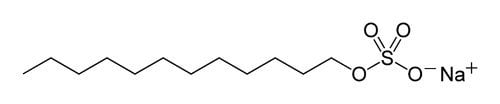
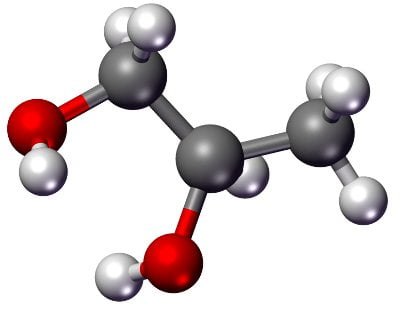
Estas dos moléculas son surfactantes muy eficaces, de modo que se usan más frecuentemente cuando se quiere un producto que forme mucha espuma que dure mucho tiempo. Son los equivalentes modernos del palmitato de potasio primitivo que mencionamos antes. También verás, casi con seguridad, un equivalente de la glicerina. A veces será el propio glicerol, a veces compuestos que lo contienen, y a veces será una molécula llamada propilenglicol, propano-1,2-diolo, en los ingredientes de los jabones, Propylene glycol.
Esta molécula (C3H8O2) desempeña el mismo papel que el glicerol, y se emplea a menudo en vez de él en los jabones modernos (aunque siga usándose también la glicerina): es un muy potente humectante, es decir, tiene las mismas propiedades higroscópicas, la misma “sed de agua” que la glicerina, con lo que proporciona un carácter hidratante al jabón.
De modo que, sí, hoy en día tal vez tengamos jabones de agradable olor, con moléculas bastante más complejas que el palmitato de potasio y similares, fabricados (en la industria, claro, porque sigue habiendo gente que los fabrica de manera tradicional)… pero bien podríamos seguir produciéndolo, como los galos, con sebo y cenizas, ¡pero eso sí, idealmente con cenizas de haya y grasa de cabra!
En el siguiente artículo de la serie, un invento físico: el reloj.
__________
Créditos: Pedro Gómez-Esteban González. (2009). El Tamiz. Recuperado de: https://eltamiz.com/