Lo nuevo

La Catástrofe Ultravioleta y el infinito (parte III)

La Catástrofe Ultravioleta y el infinito (parte II)

La Catástrofe Ultravioleta y el infinito (parte I)






El invento del que hablaremos hoy, como sucede a veces en la serie Inventos ingeniosos, no tiene nada que ver con el anterior (el teléfono). Por si no conoces esta serie, en ella miramos con detenimiento cosas que tenemos alrededor y en las que a veces no pensamos, para escudriñar su historia, el cómo y el porqué de su funcionamiento… pero en este caso unos cuantos de vosotros sí habéis pensado en el invento de hoy, porque ha sido una sugerencia común de varios lectores habituales (de ahí que le dediquemos un artículo). Hoy hablaremos del pegamento.
A diferencia de algunos de los inventos que hemos mencionado últimamente, el origen del pegamento se pierde en la prehistoria. La razón es evidente, comparando con el último artículo de la serie: conseguir hablar con alguien que está a mil kilómetros de distancia es difícil, y requiere de una tecnología relativamente avanzada. Lograr que dos cosas se adhieran utilizando alguna sustancia sólo requiere de mirar a tu alrededor y pensar un rato, y no demasiado largo.
Por lo tanto, el concepto de “pegamento”, en su forma más primitiva, se descubrió múltiples veces en lugares distintos, con éxitos variados, y es imposible dar una fecha exacta de su primera utilización. Si alguna vez has notado como tus dedos se quedaban pegados y pringosos tras tocar la resina de un pino o cualquier otro árbol resinoso, miel o agua con azúcar, sabes lo que quiero decir.
El primer uso documentado que conocemos es realmente antiguo, tanto que ni siquiera se debe al Homo sapiens: se trata de restos de alquitrán vegetal, con una huella dactilar y signos de haber sido trabajado con una herramienta de sílex, encontrados en Königsaue, Alemania. Aunque siempre es difícil estar absolutamente seguros de la fecha exacta y autoría de cosas así, los arqueólogos piensan que el trozo de alquitrán tiene unos 80 000 años y fue utilizado por una tribu Neanderthal para ayudar a unir cabezas de herramientas o armas a sus mangos. Detalles aparte, es evidente que la tecnología más primitiva produce algún tipo de pegamento de manera casi inevitable.
El alquitrán de origen vegetal ha sido, de hecho, uno de los dos tipos fundamentales de pegamento empleados por el ser humano durante milenios (en un momento hablaremos del otro). Básicamente se trata de un refinamiento del simple hecho de coger resina. Se calienta madera –que puede ser de pino, corteza de abedul u otras, dependiendo de la zona– hasta 400-700 ºC, en ausencia de oxígeno para que no arda, y el resultado es doblemente provechoso: por un lado, se obtiene carbón vegetal, que tiene un poder calorífico muy superior al de la madera. Por otro lado, se obtiene alquitrán vegetal, que es mucho más resistente que la resina y mantiene la adhesión con más intensidad y durante más tiempo.

Pero hay muchas otras soluciones de baja tecnología para obtener sustancias similares, sobre todo si no importa demasiado el poder adhesivo o que la adhesión dure muchos años: puede emplearse simplemente miel o cera de abejas, clara de huevo, harina con agua, azúcar con agua, goma arábiga, látex… hay tantos métodos posibles que es absurdo plantearse una cultura, incluso aunque no tenga una tecnología avanzada, que no haya empleado más de un “pegamento” diferente.
Aparte del alquitrán de origen vegetal, el otro rey de los pegamentos naturales es la cola de origen animal, obtenida generalmente cocinando restos animales ricos en tejido conjuntivo (o conectivo). Estoy convencido, aunque no he conseguido encontrar datos de sus primeros usos más allá de los egipcios, que la cola animal tiene también su origen en la prehistoria: es aún más fácil de obtener que el alquitrán que he mencionado antes, si se dispone simplemente de un animal muerto y una olla con agua.

Tan común fue su uso desde tiempos ancestrales que el nombre que damos hoy al colágenoproviene del griego kolla, es decir, cola, ya que los griegos producían cola animal, como todas las culturas contemporáneas, a mansalva. “Colágeno” es algo así como “generador de pegamento”, tal ha sido su importancia en ese aspecto a lo largo de nuestra historia. Cuando se cocina cualquier resto que tenga colágeno (y lo hay en la piel, en los huesos, en los tendones…) éste se rompe por hidrólisis y forma una gelatina que sirve bastante bien de pegamento, aunque tiene sus limitaciones: igual que el alquitrán vegetal, no es tan resistente como los pegamentos químicos modernos, y no aguanta bien las altas temperaturas.
Sin embargo –como siempre que hablo de algo de lo que no sé, son bienvenidas las correcciones y ampliaciones–, creo que la cola de origen animal se sigue usando en determinados trabajos más o menos artesanales que requieren de sus propiedades específicas, como sucede en la construcción de algunos instrumentos musicales de categoría, ya que los pegamentos químicos impedirían poder abrirlos sin dañar la madera, y con la cola animal se puede despegar y luego volver a pegar una pieza con otra sin problemas. A veces, no ser un adhesivo muy fuerte es mejor que serlo.
Además, según lo que nos comenta dyopithecus, la estructura a nivel molecular de la cola animal curada, al ser más ordenada que la de pegamentos sintéticos, transmite mejor el sonido entre piezas del instrumento.
De modo que, durante milenios, empleamos básicamente materia vegetal o animal “cocinada” para producir sustancias pegajosas, que funcionaban bastante bien pero no pegaban con demasiada intensidad ni duraban mucho tiempo. Para llegar más allá hacía falta una química científica, algo que nos llevó bastante desarrollar, y sobre todo una química orgánica avanzada, por razones que discutiremos luego. Hacían falta pegamentos químicos, y tuvimos que esperar hasta el siglo XX para obtenerlos – son esos pegamentos los que tú, querido y paciente lector de El Tamiz, has utilizado seguramente a lo largo de tu vida, aunque los nombres técnicos son bastante más raros que los que solemos emplear.
En 1912, el químico alemán Fritz Klatte nos proporcionó el primero de ellos. Klatte descubrió que, al hacer reaccionar eteno (o etileno, C2H4) con el ácido acético (CH3COOH) del vinagre, se obtenía agua y otro compuesto, el acetato de vinilo (C4H6O2); y este compuesto podía unirse a sí mismo, formando larguísimas cadenas con eslabones de acetato de vinilo. Se obtenía así un polímero gomoso, flexible y de olor intenso: el poliacetato de vinilo o PVA (del inglés polyvinyl acetate).

Es posible que ese nombre no te diga mucho, pero te aseguro que lo has utilizado muchas veces: no es ni más ni menos que la base de la cola blanca. Básicamente, el PVA forma una emulsión con agua, y cuando se deja al aire, el agua se va evaporando, la cola se seca y se endurece. Aunque ya sé que desde entonces hemos desarrollado pegamentos más resistentes y que se fijan antes, el PVA fue una verdadera revolución en la historia del pegamento: demostró que, utilizando nuestros conocimientos químicos, podíamos crear un adhesivo más potente que los naturales que habíamos empleado hasta entonces. Además, la cola blanca es baratísima de producir y menos peligrosa que muchos otros adhesivos químicos, con lo que seguimos utilizándola hoy en día.
El siguiente avance necesario era obtener un adhesivo rápido: algo que no requiriese de un largo secado, como el del poliacetato de vinilo. Para eso hubo que esperar de nuevo a que la química orgánica avanzase, y a que se produjese una de esas coincidencias sin las que esta serie sería mucho más aburrida. Puedo garantizar que, igual que la cola blanca, también lo conoces y lo has utilizado, pero remontémonos a sus sorprendentes orígenes.
El año: 1942, en plena Segunda Guerra Mundial. En los laboratorios de la empresa Kodak, Harry Coover se encontraba experimentando con diversas resinas acrílicas para tratar de obtener un plástico transparente que pudiera emplearse en las miras telescópicas de los rifles. Como sucede en estos casos, hubo muchos ensayos, mucha prueba y error: algunos materiales no eran suficientemente transparentes, otros no tenían la suficiente consistencia… y uno de ellos era insufrible, endiabladamente pegajoso. Se trataba del metil 2-cianoacrilato (C5H5NO2), y Coover, evidentemente, lo descartó.
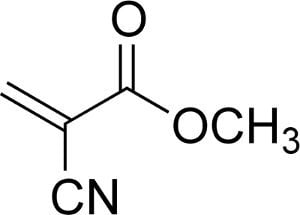

Sin embargo, unos años después, en 1951 Coover volvió a toparse con este pegajoso compuesto de nuevo. Esta vez estaba trabajando para Eastman junto con Fred Joyner para desarrollar un plástico transparente para la cabina de aviones de combate. Sí, lo has adivinado: el metil 2-cianoacrilatohizo su aparición y fue descartado por pegajoso una segunda vez. Pero en este caso Coover, Joyner y la propia empresa no dejaron la cosa ahí, y siguieron experimentando con el compuesto y otros similares (llamados, en general, cianoacrilatos), pero esta vez para lo que de verdad servían: para pegar cosas.
En 1958 la empresa patentó el Eastman #910, y los cianoacrilatos pronto se convirtieron en una revolución, y fueron comercializados con muchos nombres diferentes por empresas distintas. Aunque las propiedades de unos y otros eran relativamente distintas, todos tenían unas propiedades fundamentales en común, y siguen siendo hoy uno de los pegamentos más utilizados. Dependiendo del país en el que vivas, habrás empleado cianoacrilatos bajo el nombre de Loctite, Superglue (que puedes ver a la izquierda (Wikipedia/FDL), Krazy Glue, Kola Loka, La gotita, Pegaloca…, de modo que estoy seguro de que conoces bien su comportamiento y apariencia.
Sin embargo, puede que no sepas algunas cosas curiosas sobre los cianoacrilatos. Por ejemplo, mientras que la cola blanca se endurece cuando se seca, decir que un cianoacrilato “se seca”, aunque todos nos entendamos, es incorrecto. No sólo eso, es lo más alejado de la realidad que podría decirse, porque estos compuestos funcionan exactamente al revés: en su forma líquida, las moléculas están sueltas, pero cuando se ponen en contacto con iones hidroxilo (OH-), el cianoacrilato hace lo mismo que Klatte había logrado con el acetato de vinilo: se polimeriza. Forma largas cadenas, se convierte en un sólido y “se seca”.
Pero ¿dónde se encuentran más comúnmente iones hidroxilo? ¡En el agua! Si tratases de pegar algo con un cianoacrilato y no hubiera ni pizca de agua cerca, no conseguirías pegar nada, porque lo que hace no es “secarse”, es “humedecerse” para volverse sólido. Evidentemente, no hacen falta muchos iones OH- para que estos compuestos se polimericen, o estaríamos mojándolos para pegar cosas. Simplemente con la humedad del aire basta. De hecho, si te dejas un bote abierto, el problema no es que se evapore nada (los cianocrilatos se evaporan y pueden resultar tóxicos, pero eso no hace que se “sequen”), sino que entre aire húmedo y esto haga que se polimerice y solidifique.
Por eso probablemente has notado una propiedad bastante irritante de estos pegamentos: estás intentando pegar algo, y no lo consigues bien. Sin embargo, te cae una gotita en el dedo, tocas otro dedo… ¡y se quedan pegados con una rapidez tremenda! ¿Por qué? Porque nuestra piel suele estar bastante más húmeda que el ambiente, con lo que somos perfectos para que los cianoacrilatos se polimericen sobre nosotros (esto es importante, y de ello hablaremos en un momento).
Ya sé que saber todo esto no es demasiado práctico (aunque espero que sí curioso), pero sí puedo darte información que te sirva la próxima vez que uses un cianoacrilato (además de poder decir “voy a usar un cianoacrilato” y ganarte el respeto de tus amigos y familiares… o tal vez no): si no consigues que dos superficies se peguen bien, prueba a echar tu aliento sobre ellas justo antes de poner el pegamento. La humedad “extra” puede ayudar bastante.
Otro dato que también puede resultarte útil: los cianoacrilatos reaccionan con algunas fibras naturales, como el algodón, de manera exotérmica, con lo que las calientan, y si la temperatura es lo suficientemente alta pueden llegar a hacerlas arder. Moraleja: no pegues cosas de algodón con cianoacrilatos así como así.
Por otro lado, si estás perdido en el bosque y no tienes cerillas, pero sí una algodón y Superglue… pues ya sabes. Y, ya que hablamos de supervivencia, los cianoacrilatos también se utilizan en medicina: su “avidez de agua” los hace adhesivos casi perfectos para cerrar heridas, que suelen estar bien húmedas. Se realizaron ya pruebas en la Guerra de Vietnam, aunque los primeros cianoacrilatos, como el metil 2-cianoacrilato de Coover, eran irritantes de la piel. Aunque los pegamentos comerciales de hoy, en su mayoría, también lo son (porque pegan mejor que los que no lo son), hoy en día se emplean cianoacrilatos no irritantes como sustitutos de los famosos “puntos” en determinadas situaciones – no sé cuándo ni cómo, así que si hay algún médico en la sala que sepa de esto, ampliamos un poco el artículo.
Otra propiedad curiosa (y que no está de más conocer) de los cianoacrilatos es que, si la temperatura baja lo suficiente, se vuelven frágiles y quebradizos. Si tienes algún objeto pegado que quieres separar pero no tienes acceso a la superficie pegada (si lo tienes, sigue leyendo), puedes conseguir separarlo metiéndolo en el congelador, ¡si cabe, claro!
Finalmente, los cianoacrilatos se disuelven muy bien en diversas sustancias orgánicas. Como he dicho antes, mojar estos pegamentos para reblandecerlos no sirve de nada (salvo que el agua esté muy, muy caliente, pero entonces no es el agua quien lo logra, sino el calor), pero pueden emplearse disolventes orgánicos. El mejor de todos es el cloruro de metileno (o cloruro de meteno), que desgraciadamente es tóxico. El más empleado por su ubicuidad es la propanona, la acetona del quitaesmalte.
Antes de seguir con algunos otros pegamentos químicos modernos, ¿ves ya en qué se parecen todos los que hemos descrito hasta ahora? Aunque unos pegamentos funcionan de manera diferente a otros a nivel microscópico, la idea general es siempre la misma, y voy a tratar de explicarla de la manera más sencilla posible. Si eres químico, tápate los ojos o visita alguna página seria, o puede que sufras manía homicida cuando leas los siguientes párrafos y te veas expuesto a las simplificaciones que voy a hacer. Estas avisado.
Todos los adhesivos que hemos mencionado tienen dos cosas en común: moléculas larguísimas, en una emulsión de algún líquido en unos casos, o “rotas” en sus eslabones en otros, pero en estado más o menos líquido, con viscosidad variable en cualquier caso; y un endurecimiento, ya sea por la evaporación del disolvente o por la reacción con algún compuesto, que o bien construye esas largas cadenas (polímeros) o bien las fija cuando se quedan sin el líquido. Y todos tienen estas cosas en común por algo, claro.
Básicamente, cualquier pegamento es muy “móvil” cuando no se ha “curado”: o bien los eslabones de los polímeros o bien los propios polímeros, al formar parte de un líquido, pueden moverse con relativa libertad, de modo que se entrelazan alegremente unos con otros, se introducen en los poros de los materiales con los que entran en contacto, e incluso se unen en distintos puntos a esos materiales debido a enlaces de hidrógeno, fuerzas de van der Waals o incluso enlaces químicos “de verdad”. Si no pudieran moverse con esa libertad, tal vez en algunos puntos se uniesen a los otros materiales por casualidad, pero no podrían “encajar” en tantos puntos de anclaje como lo hacen mientras son “libres”.
La segunda parte del proceso es justo la contraria: algo desencadena una “solidificación”, y los polímeros se quedan donde están, sin posibilidad de moverse con tanta libertad como antes. Antes estaban más o menos entrelazados entre ellos aunque se podían deslizar, pero ahora esos “nudos” los amarran, creando una masa consistente. Y antes se habían deslizado sobre los materiales que tocaban, retorciéndose y adaptándose a ellos hasta formar muchos “puntos de anclaje”, químicos o simplemente físicos. Pero con la nueva inmovilidad tras “secarse” (ya hemos visto que esto puede significar justo lo contrario, pero entiendes lo que quiero decir), todos esos puntos de anclaje son ahora permanentes.
Por eso, cuando se ha curado, puedes tocar el pegamento sin quedarte pegado: puede que las moléculas de tu dedo formen, por casualidad, algún enlace con alguno de los polímeros, pero como éstos no pueden moverse para colocar sus eslabones en los sitios adecuados, no se conseguirá formar ni de lejos el número necesario de enlaces para que lo notes. La inmovilidad de los polímeros los incapacita para “agarrarse” a nada de forma eficaz.
Lo que se tiene entonces es una especie de madeja de miles de millones de hilos, que forman nudos unos con otros y que están unidos al otro material, con fuerzas muy pequeñas en cada punto, pero en millones de puntos. La fuerza que logran todos juntos puede llegar a ser muy grande, ya que se trata de “hilos” de tamaño molecular, con lo que hay una cantidad ingente de ellos por unidad de superficie.
¿Qué es lo que determina entonces las propiedades de uno u otro pegamento de los que hemos hablado y de los que hablaremos en un momento? Por un lado, el grado de resistencia, que depende del tamaño de los polímeros, el número de “puntos de anclaje” que pueden formar con los distintos materiales y la fuerza de esos enlaces, que depende de si son físicos o químicos y de qué clase. Por otro, el tipo de condiciones que desatan el “curado” del pegamento – temperatura, compuestos químicos, humedad, lo que sea, y el tiempo que se tarda en producir ese “secado”. Y finalmente, el tipo de condiciones que pueden volver de nuevo “móviles” a los polímeros, o romper sus eslabones – una vez más, temperatura, humedad, compuestos químicos como la acetona, etc.
De modo que, si te explico cómo funcionan algunos otros de los pegamentos modernos, verás que son similares en concepto a los que hemos visto, y no voy a detenerme tanto en ellos porque tampoco es para eso. Son muy comunes las resinas epoxi, que funcionan de un modo similar a los cianoacrilatos.
Si las has usado, sabes que son dos “pastas” diferentes, que suelen tener colores diferenciados para que no haya confusiones y que a veces se llaman “resina” y “endurecedor”. Por separado, son más o menos viscosas: cada una de ellas está formada por monómeros (“eslabones” de la futura cadena), que no se unen unos a otros. Sin embargo, cada extremo de los eslabones de la resina puede unirse a un extremo de los eslabones del endurecedor, y también a los materiales con los que entra en contacto. Por lo tanto, cuando se mezclan las dos pastas, rápidamente los eslabones van enlazándose unos con otros, alternados los de la resina y el endurecedor, con lo que se produce la polimerización, es decir, la formación de los largos “hilos” que se entrelazan y proporcionan la resistencia al pegamento ya curado.
Las resinas epoxi se utilizan en muchos campos, y especialmente en la industria, ya que son de los pegamentos industriales más resistentes. Fueron desarrolladas en los años 30 por Grenlee y Castan, y no son tan frecuentemente usadas como los cianoacrilatos o el poliacetato de vinilo, porque son más caras y, según el tipo, pueden ser más tóxicas.
Finalmente, no quiero terminar sin mencionar los pegamentos termofusibles, que tienen un mecanismo de funcionamiento que estoy seguro comprenderás bien si has entendido lo anterior. Estos pegamentos están formados por polímeros que pueden deslizarse unos sobre otros cuando superan cierta temperatura (dependiendo del uso que se le quiera dar y el peligro que se quiera aceptar al emplearlos, se elige una temperatura u otra), con lo que se licúan y fluyen muy bien, como fideos recién hechos. Por tanto, normalmente se introduce una barra del polímero en una pistola de pegamento, que tiene una resistencia eléctrica que calienta el polímero por encima de su temperatura de fusión, con lo que por el “cañón” de la pistola sale un fluido viscoso formado por cadenas del polímero “resbaladizas”, que luego, al enfriarse de nuevo, vuelven a entrelazarse y pegarse entre ellos, atrapándose unos a otros y al material sobre el que se han vertido.

Desde luego, hay muchos otros tipos de pegamentos y colas, pero creo que tras hablar de estos puedes comprender el mecanismo básico de funcionamiento de todos los demás. Según avanza nuestra ingeniería química, somos capaces de crear pegamentos más resistentes, que soporten una variedad de condiciones mayor, y que se “curen” más deprisa… idealmente, reduciendo al mismo tiempo su toxicidad, aunque todo esto depende, por supuesto, del fin al que queremos destinarlos, ya que a veces estamos dispuestos a renunciar a alguna de estas propiedades para que otra sea como deseamos.
Espero que, especialmente quienes pedísteis esta entrada, hayáis disfrutado con tanta palabreja extraña y sepáis más o menos lo que está pasando cuando hagáis reaccionar el cianoacrilato con el H2O del ambiente para “atar” una superficie a otra con polímeros. Se siguen aceptando sugerencias para las próximas entregas de la serie. En la próxima hablaremos del jabón.
__________
Créditos: Pedro Gómez-Esteban González. (2009). El Tamiz. Recuperado de: https://eltamiz.com/